News
2023.09.07
知財ニュース
動力アシスト機能付きパワード義足「Bio Leg®」、米国食品医薬品局(FDA)クラスⅡ医療機器に登録

BionicM株式会社は、同社が開発した動力アシスト機能付きパワード義足「Bio Leg®」について、米国FDA(食品医薬品局)のクラスⅡ医療機器登録が完了したことを発表した。
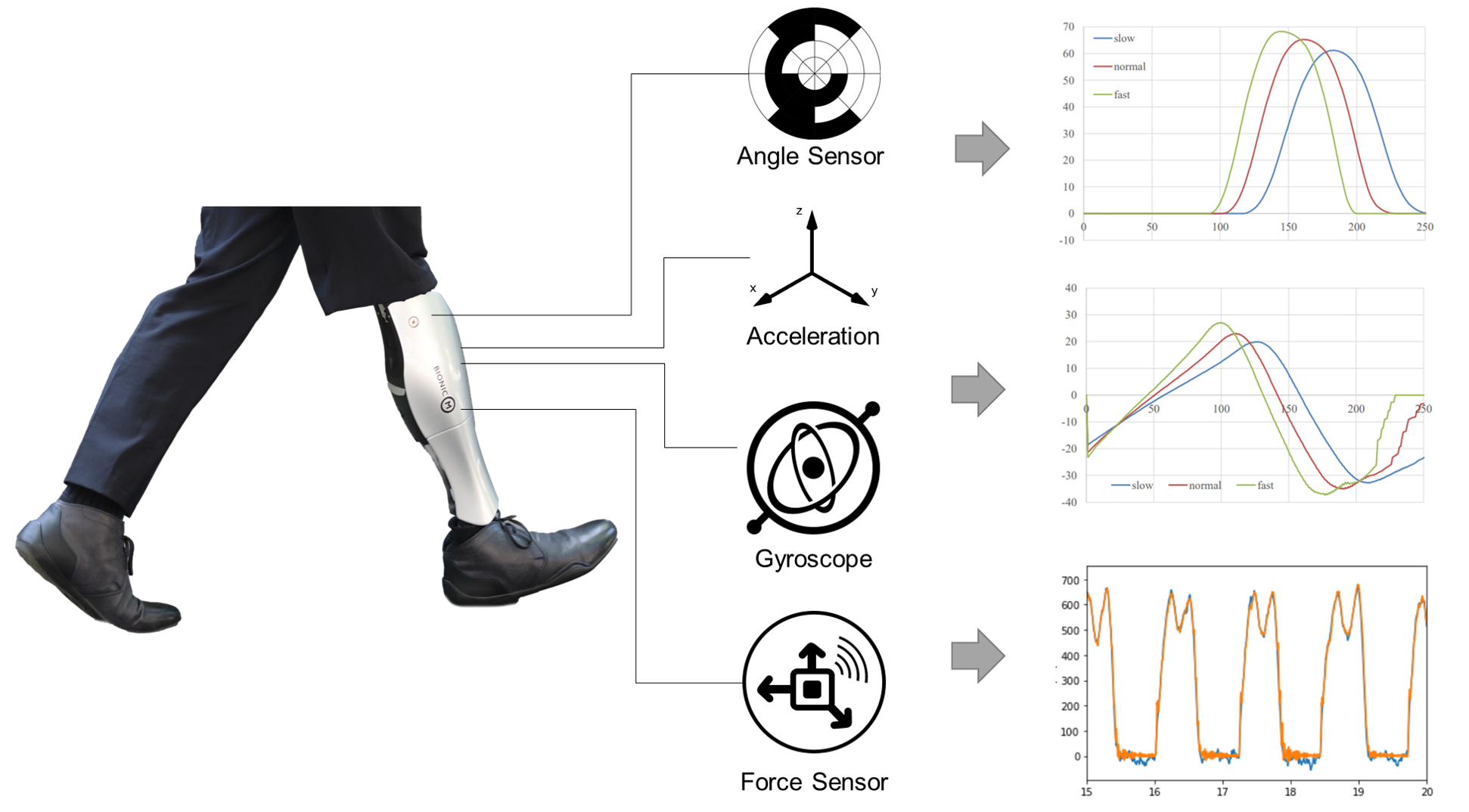
Bio Leg®は、東京大学が世界をリードするヒューマノイドロボティクス技術を活用し、膝の屈曲伸展を能動的に行える動力アシスト機能をもったパワード義足。
今回Bio Leg®は、2023年7月に、米国FDA(Food and Drug Administration、食品医薬品局)にてクラスⅡ 510(k)免除の医療機器として登録が完了した。
現在世界で流通している義足は動力アシスト機能を持たないものが主流であり、義足ユーザーにとって、身体的負担の大きさや日常動作に制限が生じることか懸念されている。
Bio Leg®は、脚の切断により失われた筋力を義足の動力で代替することで、装着者の身体的負担を軽減するとともに、より自然な動作、アクティブな活動をサポートし、日常生活動作の幅を広げることが期待されている。
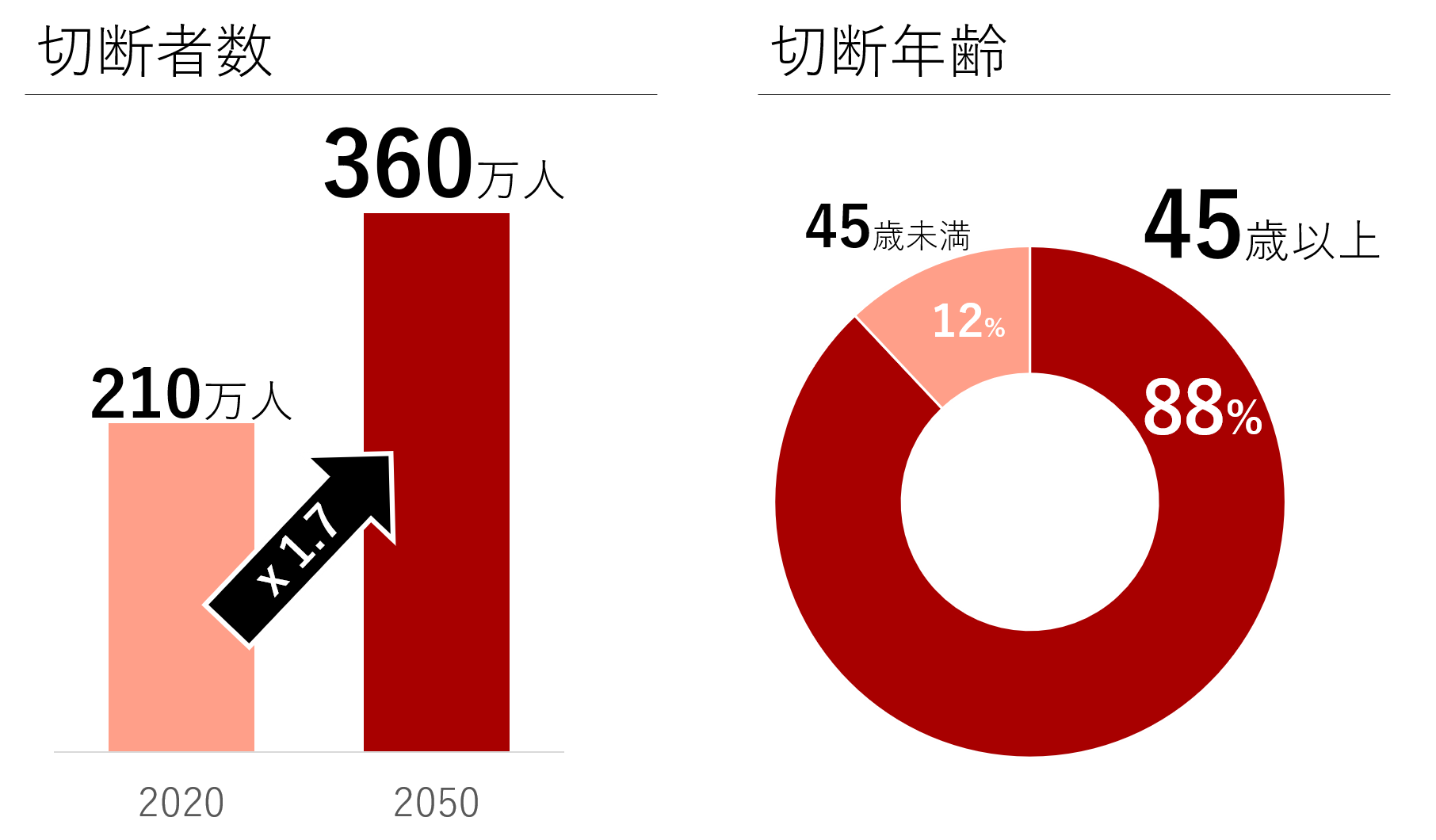
米国の義肢装具市場は2022年時点で43億ドルにのぼると推定されており、2020年時点で210万人いるとされる四肢切断者数が、2050年には360万人まで増加することが見込まれている。 また、切断年齢は45歳以上の切断者数が全体の88%を占めており、筋力の衰えた高齢者など低活動の義足ユーザー増加に伴い、動力アシスト機能をもつ義足へのニーズが高まることが予想される。
Bio Leg®の製品コンセプトは、世界最高峰のデザイン賞のひとつである2020年度「Red Dot Award」デザインコンセプト部門において、グランプリにあたる「Luminary(ルミナリー)」を受賞しており、機能面に加えてデザイン面でも世界で高く評価されている。
今回のFDA登録は、同社の米国市場への参入と事業成長を加速させていくとしている。
同社代表取締役社長孫小軍氏は「今回のFDA登録は、足を失った人々のモビリティを革新的に向上させるための大きなマイルストーン。今後米国市場で販売を開始し、すべての人々のモビリティに力を与えるミッション「Powering Mobility for All」の達成に向けて、さらに事業を加速させていきたい」と抱負を述べている。
BionicM 公式サイト
関連記事:「パワード義足を開発するBionicM株式会社、資金調達実施と新経営体制強化を発表」
Top Image : © BionicM 株式会社






